La lecture de ce document dénonce le piège mortel que représente la présence du VIH1, le virus du SIDA, dans le vaccin ChAdOx1 nCoV-19, qu’on voulait nous administrer. Nous nourrissons notre curiosité en donnant la parole à Professeur Jean-Bernard FOURTILLAN, Docteur Serge RADER, Docteur Christian Tal SCHALLER, Didier ROCHARD, Frédéric CHAUMONT…
Table des matières
Les caractéristiques du VIH, le virus du SIDA
Car une des caractéristiques de ce rétrovirus VIH1, le virus du SIDA (vaccin ChAdOx1 nCoV-19), est de s’intégrer dans l’ADN du génome humain, pour la vie.
Avertissement
DOCUMENT-13 Pourquoi la présence du virus du SIDA dans le vaccin ChAdOx1 nCoV-19 rend ce vaccin mortel
En effet, la transcriptase inverse, ou rétrotranscriptase, du VIH est une enzyme qui transcrit l’information génétique du VIH supportée par son ARN en ADN correspondant, qui va s’intégrer dans le génome de l’hôte, de manière irréversible.

Le VIH infecte les cellules vitales du système immunitaire humain, telles que les
cellules T CD4 + (lymphocytes T4), les macrophages et les cellules dendritiques. L’infection par le VIH conduit à la mort des lymphocytes T CD4 +, grâce à un certain nombre de mécanismes. Lorsque le nombre de lymphocytes T CD4 + diminue en dessous d’un niveau critique, l’immunité à médiation cellulaire est perdue et le corps devient progressivement plus sensible aux infections opportunistes, conduisant au développement du SIDA.
Le Virus de l’immunodéficience humaine
Structure

Le VIH est un rétrovirus du genre des lentivirus (du latin lentus « lent »), qui se caractérisent par une longue période d’incubation avec, par conséquent, une évolution lente de la maladie.
Le VIH-1 (vaccin ChAdOx1 nCoV-19) est un virus sphérique d’un diamètre moyen de 145 nanomètres. Comme de nombreux virus infectant les animaux, il dispose d’une enveloppe composée d’un fragment de la membrane de la cellule infectée.
Dans cette enveloppe lipidique sont insérés des trimères de glycoprotéine d’enveloppe (Env). Chaque protéine Env est formée de 2 sous-unités : une sous-unité de surface gp120 et une sous-unité transmembranaire gp41.
La surface d’un virus VIH contiendrait en moyenne seulement 14 trimères Env. Lors de l’attachement du virus à la cellule, la protéine Env gp120 se lie à un récepteur CD4 (lymphocyte T4), présent à la surface des cellules CD4+ du système immunitaire.
C’est pour cette raison que le VIH n’infecte que des cellules ayant ce récepteur à leur surface, qui sont en très grande majorité les lymphocytes CD4+.
Le VIH infecte les cellules vitales du système immunitaire humain, telles que les cellules T auxiliaires (en particulier les cellules T CD4 +), les macrophages et les cellules dendritiques.
L’infection par le VIH entraîne de faibles taux de lymphocytes T CD4 + grâce à un certain nombre de mécanismes, y compris la pyroptose des lymphocytes T infectés de manière abortive, l’apoptose des cellules non infectées non infectées, la destruction virale directe des cellules infectées et la mort des lymphocytes T CD4 + infectés par les cellules infectées.
Lorsque le nombre de lymphocytes T CD4 + diminue en dessous d’un niveau critique, l’immunité à médiation cellulaire est perdue et le corps devient progressivement plus sensible aux infections opportunistes, conduisant au développement du SIDA (vaccin ChAdOx1 nCoV-19).
À l’intérieur de l’enveloppe, se trouve une matrice protéique (MA) composée de protéines p17 et, encore à l’intérieur, la capside (CA) composée de protéines p24.
C’est ce dernier type de protéines qui, avec gp41 et gp120, sont utilisés dans les tests VIH western blot.
ChAdOx1 nCoV-19
Les protéines nucléocapside (NC) protègent l’ARN viral en le recouvrant. La protéine p6 est exclue de la capside et se trouve entre la matrice et la capside, elle permet la sortie par bourgeonnement des virus nouvellement formés dans la cellule.
Le génome du VIH (vaccin ChAdOx1 nCoV-19), contenu dans la capside, est constitué d’un simple brin d’ARN en double exemplaire (9181 nucléotides), accompagné d’enzymes :
- – La transcriptase inverse ou rétrotranscriptase qui rétrotranscrit l’ARN viral en ADN viral.
- – L’intégrase qui intègre l’ADN viral à l’ADN cellulaire.
- – La protéase qui participe à l’assemblage du virus en clivant les précurseurs protéiques Gag p55 et Gag-Pol p160. La protéase est présente dans la capside.
Ces trois enzymes sont les principales cibles des traitements antirétroviraux, car elles sont spécifiques aux rétrovirus.
Le génome du VIH (vaccin ChAdOx1 nCoV-19) est composé de neuf gènes. Les trois principaux sont gag, pol et env, qui définissent la structure du virus et sont communs à tous les rétrovirus. Les six autres gènes sont tat, rev, nef, vif, vpr et vpu, qui codent des protéines régulatrices.
Transmission
Le VIH est présent dans de nombreux fluides organiques. On en a retrouvé dans la salive, les larmes et l’urine, mais en des concentrations insuffisantes pour que des cas de transmission soient enregistrés. La transmission par ces fluides est considérée de ce fait comme négligeable.
En revanche des quantités de VIH (vaccin ChAdOx1 nCoV-19) suffisamment importantes pour déclencher une infection ont été détectées dans le sang, le lait maternel, la cyprine, le sperme, ainsi que le liquide précédant l’éjaculation et la concentration du virus dans les sécrétions génitales (sperme et sécrétions au niveau du col de l’utérus chez la femme) sont de bons prédicteurs du risque de transmission du VIH à une autre personne.
Par voie de conséquence, les trois modes de contaminations sont :
– les rapports sexuels non protégés. Qu’ils soient hétérosexuels ou homosexuels, ils représentent la part la plus importante des contaminations
– le contact avec du matériel contaminé chez :
– les toxicomanes, par injection
– les tatouages, par une mauvaise hygiène du matériel
– les transfusés
– le personnel de santé
– la transmission mère-enfant, durant la grossesse, pendant l’accouchement et lors de l’allaitement.
Sans traitement et avec un accouchement naturel, le taux de transmission varie, selon les études, entre 10 et 40 %.
A lire aussi
- L’Afrique risque d’être la ‘’grande oubliée des vaccins Covid-19’’, selon l’OMS
- 196 nouvelles contaminations et 11 décès Coronavirus rapportés lundi
- Des scientifiques se penchent sur la fiabilité des vaccins contre le Covid-19
C’est durant l’accouchement que les risques d’infection sont les plus élevés (65 % de tous les cas d’infection). Un traitement et la pratique éventuelle d’une césarienne peuvent faire baisser ce chiffre à 1 %.
Cycle de réplication
Les cellules cibles du VIH sont celles présentant des récepteurs CD4 à leur surface.
Ainsi, les lymphocytes T CD4+, les macrophages, les cellules dendritiques et les cellules microgliales cérébrales peuvent être infectées par le VIH (vaccin ChAdOx1 nCoV-19). Ainsi, la réplication virale a lieu dans plusieurs tissus.
La réplication du virus se déroule en plusieurs étapes :
La fixation ou attachement à une cellule
Cette étape repose sur une reconnaissance entre les protéines de la surface virale gp120 et les récepteurs CD4 de la cellule cible.
Après l’union avec un récepteur CD4, gp120 change de conformation et est attiré vers un corécepteur devant également être présent à côté de la molécule CD4.
Plus d’une dizaine de corécepteurs ont été identifiés, mais les principaux sont CXCR4 pour les lymphocytes T CD4+ et CCR5 pour les macrophages.
Processus d’attachement du VIH

1- Fixation de la gp 120 au récepteur CD4 (vaccin ChAdOx1 nCoV-19)
2- Fixation d’une boucle variable de la gp 120 au corécepteur et fixation de la gp 41 sur la membrane cellulaire
3- Pénétration dans la cellule
La fusion, la pénétration et la décapsidation
C’est la seconde étape de l’infection, intervenant juste après l’union de gp120 avec le corécepteur. Cette union libère la protéine gp41, qui se fixe sur la membrane cytoplasmique.
Par repli sur elle-même, gp41 attire l’enveloppe virale vers la membrane cytoplasmique, puis la fusion des membranes cellulaire et virale a lieu grâce à un peptide de fusion présent dans gp41.
La capside du VIH pénètre alors dans le cytoplasme de la cellule ; une fois à l’intérieur de la cellule, elle se désagrège, libérant les deux brins d’ARN et les enzymes qu’elle contenait.
Ainsi, la protéine gp120 est responsable de l’attachement et gp41 de la fusion, puis de la pénétration au sein de la cellule.
Cycle de réplication du virus de l’immunodéficience humaine
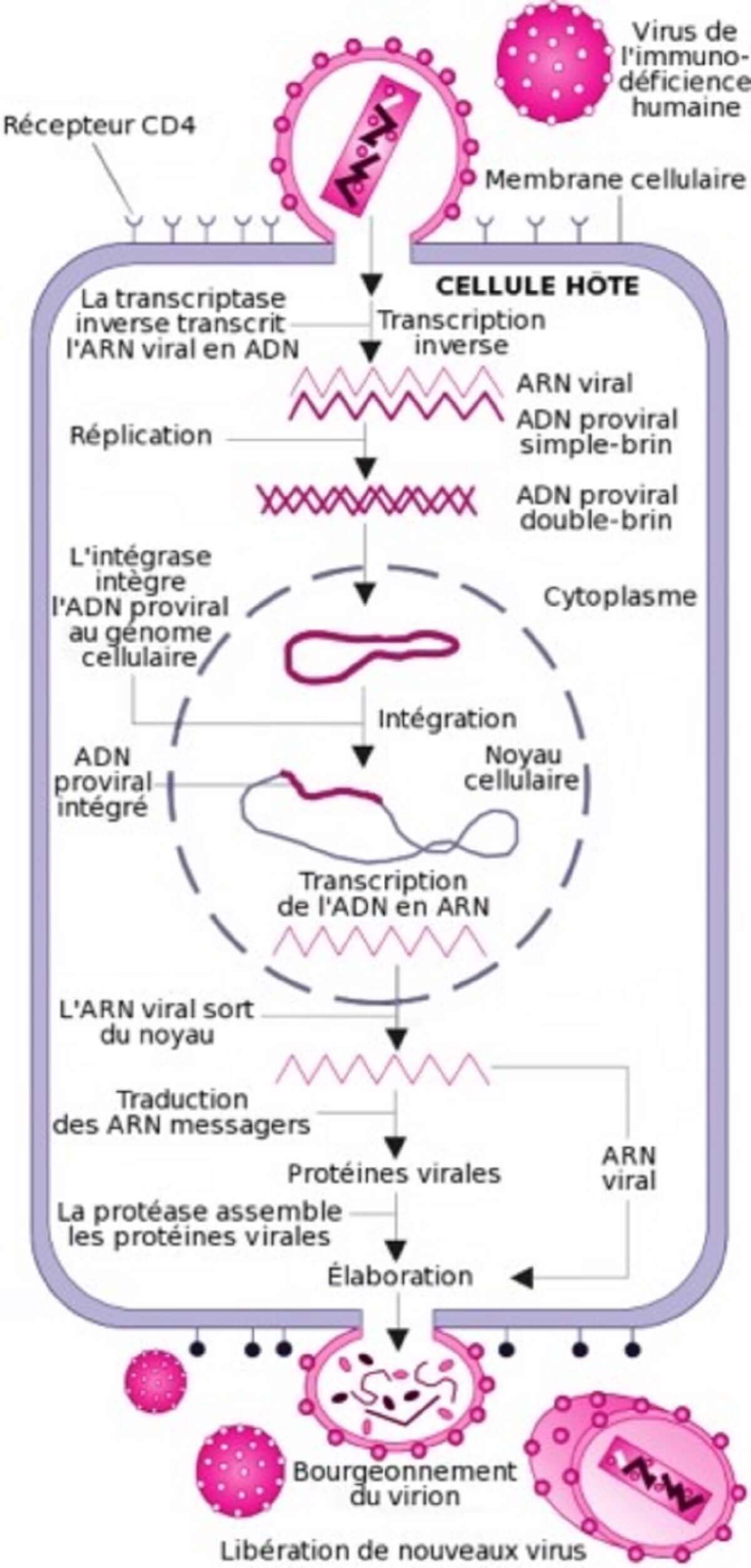
La Transcriptase inverse (vaccin ChAdOx1 nCoV-19)
Cette étape est spécifique aux rétrovirus. En effet, ces derniers ayant pour génome de l’ARN et non de l’ADN, une opération de transcription inverse (ou rétrotranscription) intervient afin de convertir l’ARN viral en une molécule d’ADN en double hélice, seule structure compatible avec celle de l’ADN cellulaire dans lequel le génome viral doit être intégré pour assurer la réplication du virus.
Cette transcription inverse est réalisée par une enzyme virale : la transcriptase inverse, une ADN polymérase ARN- dépendante associée à l’ARN viral dans la nucléocapside. Après pénétration de la capside dans le cytoplasme, la transcriptase inverse parcourt l’ARN viral et le transcrit en une première molécule d’ADN simple-chaîne, ou ADN brin (-).
Pendant cette synthèse, l’ARN matrice est dégradé par une activité ribonucléase H portée par la transcriptase inverse. La dégradation de l’ARN est totale, sauf pour deux courtes séquences riches en purines appelées séquences PPT (polypurine tracts).
Ces deux courtes séquences vont servir d’amorces à la transcriptase inverse pour la synthèse du second brin d’ADN, le brin (+), en utilisant l’ADN brin (-) comme matrice.
L’ADN final produit est ainsi une molécule en double hélice (ADN bicaténaire aussi appelé ADN double-brin). Ce processus de transcription inverse est complexe, et requiert la présence des protéines de nucléocapside fixées sur l’ARN viral puis sur l’ADN brin (-).
Une particularité de la transcriptase inverse est de ne pas être fidèle dans sa transcription et de souvent faire des erreurs. C’est la raison pour laquelle le VIH a une très grande variabilité génétique.
L’intégration
L’ADN bicaténaire pénètre dans le noyau cellulaire, selon un processus actif encore mal compris.
Cet import nucléaire constitue une particularité propre aux lentivirus qui sont, de fait, capables d’infecter des cellules en phase stationnaire, c’est-à-dire dont le noyau est intact.
Pour ce faire, l’ADN (vaccin ChAdOx1 nCoV-19) bicaténaire est, à ce moment du cycle, étroitement associé à l’intégrase et d’autres composants protéiques viraux et cellulaires, dans un complexe appelé complexe de pré-intégration.
Ce complexe possède la capacité d’interagir avec des éléments de la membrane nucléaire, pour traverser cette membrane et accéder à la chromatine cellulaire.
L’ADN s’intègre ensuite au hasard dans le génome de la cellule cible, sous l’effet de l’enzyme intégrase.
La formation d’un ARN messager
Les deux brins d’ADN de la cellule « s’écartent » localement sous l’effet de l’ARN polymérase.
Des bases azotées libres du noyau viennent prendre la complémentarité de la séquence et se polymérisent en une chaîne monobrin, l’ARNm (messager).
L’épissage
L’ARNm ainsi obtenu est hétérogène. En effet, il est constitué d’une succession d’introns (parties non codantes) et d’exons (parties codantes).
Cet ARNm doit subir une maturation pour pouvoir être lu par les ribosomes. Se passe alors une excision des introns, pour ne laisser que les exons.
La traduction de l’ARN
Une fois sorti du noyau par l’un des pores nucléaires, l’ARNm est lu par les ribosomes du RER (réticulum endoplasmique rugueux). L’ARNm (vaccin ChAdOx1 nCoV-19) vient en fait se glisser entre les deux sous-unités du ribosome.
À chaque codon (groupe de trois nucléotides) de l’ARNm, le ribosome attribue un acide aminé. Les différents acides aminés se polymérisent au fur et à mesure de la lecture.
Un codon initiateur AUG (Adénine- Uracile-Guanine) fera débuter la synthèse, tandis qu’un codon stop (UAA ; UGA ; UAG) en marquera la fin.
Maturation des protéines virales
Les polypeptides ainsi formés ne sont pas encore opérationnels, ils doivent subir une maturation dans l’appareil de Golgi.
L’assemblage (vaccin ChAdOx1 nCoV-19)
Les protéines de structure du virus (matrice, capside et nucléocapside) sont produites sous forme de polyprotéines dénommées polyprécurseurs Gag.
Les enzymes virales sont produites elles aussi sous forme de polyprotéines appelées Gag-Pol (Matrice-Capside-Nucléocapside-Protéase-ReverseTranscriptase-Intégrase).
Lorsqu’elles sortent du Golgi, les polyprotéines Gag et Gag-Pol sont transportées vers la membrane cellulaire où elles rejoignent les glycoprotéines virales membranaires.
Les domaines MA (matrice) de Gag et Gag-Pol interagissent avec la membrane, tandis que les ARN viraux sont capturés par les domaines NC (nucléocapside) de Gag et Gag-Pol.
A lire aussi
- L’Afrique risque d’être la ‘’grande oubliée des vaccins Covid-19’’, selon l’OMS
- 196 nouvelles contaminations et 11 décès Coronavirus rapportés lundi
- Des scientifiques se penchent sur la fiabilité des vaccins contre le Covid-19
Des interactions entre les différents domaines de Gag (vaccin ChAdOx1 nCoV-19), en particulier les capsides, permettent l’assemblage d’une structure globulaire conduisant à la formation d’une particule virale par bourgeonnement de la membrane plasmique.
Bourgeonnement d’un virion sur un lymphocyte en culture

La capside sort de la cellule infectée en arrachant une partie de la membrane cellulaire (à laquelle ont été préalablement fixées les protéines virales de surface (gp120 et gp41).
La maturation des virus
Les particules issues du bourgeonnement sont dites immatures. Les interactions des précurseurs Gag et Gag-Pol entraînent un rapprochement de domaines (PR) dentiques de la protéase, qui vont dimériser et former une protéase active.
Cette autoactivation de la protéase va entraîner la coupure des domaines PR aux alentours (vaccin ChAdOx1 nCoV-19), et cette réaction en chaîne va permettre l’activation de toutes les protéases virales. Ces dernières vont ensuite couper les polyprécurseurs Gag et Gag-Pol entre chacun de leurs domaines.
Ceci va libérer la Matrice de la Capside et de la Nucléocapside, cette dernière restant fixée sur l’ARN viral. Les protéines de capside, par leurs propriétés intrinsèques d’auto-assemblage, formeront la capside à la forme conique caractéristique.
Dans cette capside : la nucléocapside, formée de l’ARN viral, des protéines de nucléocapside, de la transcriptase inverse et de l’intégrase. Cette étape de maturation virale est essentielle pour rendre les virions infectieux et prêts à infecter de nouvelles cellules.
Variantes génétiques et origines du VIH
Le VIH (vaccin ChAdOx1 nCoV-19) est un virus qui a une très importante variabilité génétique et présente ainsi une extrême diversité. Deux types ont été identifiés :
– VIH-1, le plus présent dans le monde
– VIH-2, moins contagieux que VIH-1. Il sévit principalement en Afrique de l’Ouest. Il comprend le VIH-2A et le VIH-2B.
_____















